So berechnen Sie die Bond-Order und die Bond-Länge
 Share
Share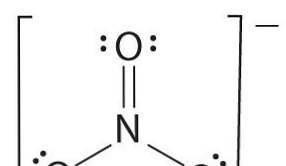
Bestimmte Parameter wie Größe, Länge und Winkel im atomaren Maßstab sind nicht einfach zu bestimmen. Aufgrund der Wichtigkeit dieser Parameter haben Wissenschaftler Methoden entwickelt, um die Parameter auf atomarer Ebene abzuleiten oder zu berechnen. Bindungsreihenfolge und Bindungslänge sind zwei wichtige Parameter, die die Art und Stärke der Bindungen zwischen zwei Atomen angeben.
Dieser Artikel erklärt,
1. Was sind Bondauftrag und Bondlänge?
2. Berechnung der Bond-Order und der Bond-Länge
- So berechnen Sie die Bond-Order
- Wie berechnet man die Bondlänge?
Was sind Bond Order und Bond Length?
Bindungslänge und Bindungsordnung sind zwei Parameter, die mit kovalenten Bindungen zusammenhängen. Die Bindungsordnung ist die Anzahl der chemischen Bindungen zwischen zwei Atomen und die Bindungslänge ist der Abstand zwischen zwei Atomkernen, die kovalent miteinander verbunden sind.In diesem Artikel wird erläutert, wie Bindungsordnung und Bindungslänge auf atomarer Ebene berechnet werden.
So berechnen Sie die Bond-Order
Die Bindungsordnung ist die Anzahl der chemischen Bindungen zwischen zwei Atomen. Es zeigt die Stabilität einer Bindung an. In kovalenten Bindungen ist die Bindungsordnung die Anzahl der gemeinsamen Elektronen. Zum Beispiel ist die Bindungsordnung eines Paares von Atomen, die durch eine Einfachbindung verbunden sind, eins, während die Bindungsordnung eines Paares von Atomen, die durch eine Doppelbindung verbunden sind, zwei ist. Die Null-Bindungsordnung zeigt an, dass keine Bindung zwischen Atomen besteht. Die Stabilität eines Moleküls steigt mit zunehmender Bindungsordnung. Die Moleküle mit Resonanzbindung müssen keine ganze Zahl sein. Bei kovalenten Verbindungen mit zwei Atomen wird die Bindungsordnung zwischen zwei Atomen bestimmt, indem zuerst die Lewis-Struktur gezeichnet und dann die Art der Bindungen zwischen den Atomen bestimmt wird - Nullbindung, Einfach-, Doppel- oder Dreifachbindung. Beispielsweise wird die Bindungsordnung von Wasserstoffgas wie folgt bestimmt.
- Zeichnen Sie die Lewis-Struktur
H: H
- Bestimmen Sie die Anzahl der Bindungen / Valenzelektronenpaare
Ein Elektronenpaar, daher ist die Bindungsordnung 1.
Wenn mehr als zwei Atome vorhanden sind, wird die Bindungsordnung wie folgt bestimmt. Siehe das Beispiel: Nitration.
- Zeichnen Sie die Lewis-Struktur

- Zählen Sie die Gesamtzahl der Bindungen (nach Nitrationen, 4).
- Die Anzahl der Bindungsgruppen zwischen einzelnen Atomen (nach Ammoniak 3)
- Daher ist die Anleiheordnung = Gesamtanzahl der Anleihen / Anzahl der Anhaftungsgruppen
= 4/3
= 1,33
Daher ist die Bindungsordnung von Nitrationen 1,33
Wie berechnet man die Bondlänge?
Die Bindungslänge ist der Abstand zwischen zwei Atomkernen, die kovalent miteinander verbunden sind. Die Bindungslänge liegt üblicherweise im Bereich von 0,1 bis 0,2 nm. Wenn zwei ähnliche Atome miteinander verbunden sind, wird die Hälfte der Bindungslänge als bezeichnet kovalenter Radius. Die Bindungslänge hängt von der Anzahl der gebundenen Elektronen von zwei Atomen oder der Bindungsordnung ab. Je höher die Bindungsordnung, desto kürzer wird die Bindungslänge durch starke Zugkräfte von positiv geladenen Kernen. Die Einheit der Bindungslänge ist Picometer. Bei Einfach-, Doppel- und Dreifachbindungen erhöht sich die Bindungslänge in der Größenordnung von
Dreifachbindung Elektronegativität kann verwendet werden, um die Bindungslänge zwischen zwei Atomen mit unterschiedlichen Elektronegativitäten zu berechnen. Die folgende empirische Formel wurde von Shoemaker und Stevenson zur Berechnung der Bindungslänge vorgeschlagen. dA-B = rEIN + rB - 0,09 (xEIN - xB) dA-B ist der Bindungsabstand zwischen zwei Atomen A und B, rEIN und rB sind kovalente Radien von A und B und (xEIN - xB) ist der Elektronegativitätsunterschied zwischen A und B. Eine andere Methode wird zur Berechnung der ungefähren Bindungslänge verwendet. Bei diesem Verfahren wird zunächst eine Lewis-Struktur gezeichnet, um den Typ der kovalenten Bindung zu bestimmen. Dann verwenden Sie ein Diagramm *, das auf den von Cordero et al., und Pyykkö und Atsumi, Die entsprechenden Radien der von jedem Atom hergestellten Bindungen werden bestimmt. Dann wird die Bindungslänge bestimmt, indem die Summe der beiden Radien genommen wird. Bei der Bestimmung der Bindungslänge von Kohlendioxid wird beispielsweise die erste Lewis-Struktur gezeichnet. Gemäß dem Diagramm beträgt der kovalente Radius der Kohlenstoffdoppelbindung 67 Pikometer und der der Sauerstoffdoppelbindung 57 Pikometer. Daher beträgt die Bindungslänge von Kohlendioxid etwa 124 Pikometer (57 pm + 67 pm).. * Hier finden Sie eine kovalente Tabelle Referenz: Cordero, Beatriz et al. „Kovalente Radien überarbeitet.“ Dalton Transactions 21 (2008): 2832-2838. Textzeilen "Bindungsreihenfolge und Längen". Chemie LibreTexts. Textbibliotheken, 05. Dezember 2016. Web. 10. Januar 2017. Lister, Ted und Janet Renshaw. Chemie für Fortgeschrittene verstehen. N.p .: Nelson Thornes, 2000. Druck. Pratiyogita Darpan. "Eigenschaften von Elementen in Bezug auf ihre elektronische Struktur." Competition Science Vision Aug. 1998: n. 1. pag. Drucken. Pyykkö, Pekka und Michiko Atsumi. "Molekulare Doppelbindungskovalente Radien für Elemente Li-E112." Chemistry-A European Journal 15.46 (2009): 12770-12779.
